محتويات المقال
فسر لماذا يحتوي طيف الانبعاث ،هل يحتوي طيف الانبعاث الذري على ترددات معينة من الضوء وهو سؤال عام في الكيمياء الثانوية ، ومهنتك المستقبلية مرتبطة بالتميز في الكيمياء ، لاحظ العلماء في أواخر القرن التاسع عشر أنه عندما تزداد طاقة ذرات عنصر معين نشع ألوانًا ضوئية محددة ، وأن هذه الألوان لم تتغير لعنصر واحد ، وكان هذا يعتبر بصمة العنصر ، ولكن السبب أنه غير معروف.فسر لماذا يحتوي طيف الانبعاث كلما زادت طاقة الإلكترون ، كلما ابتعد مداره عن النواة.كل إلكترون له مستوى طاقة معين.
اشرح سبب احتواء طيف الانبعاث الذري على ترددات معينة من الضوء
فسر لماذا يحتوي طيف الانبعاث ، يحتوي طيف الانبعاث الذري ، الجواب المباشر: لأن طاقات الذرات محدودة ، لذلك فإن ترددات معينة فقط تنبعث من الإشعاع المنبعث من الذرة ، ولكن لكي تفهم الإجابة بشكل كامل ، يجب أن تعرف ما يلي:
- فسر لماذا يحتوي طيف الانبعاث، بعد حدوث عملية التسخين لعنصر نقي ، يتم إثارة إلكتروناته ، ويتم إنتاج الموجات الكهرومغناطيسية من تلك العملية ، والانبعاث الذري هو الكثافة النسبية التي تميز الموجات الناتجة.
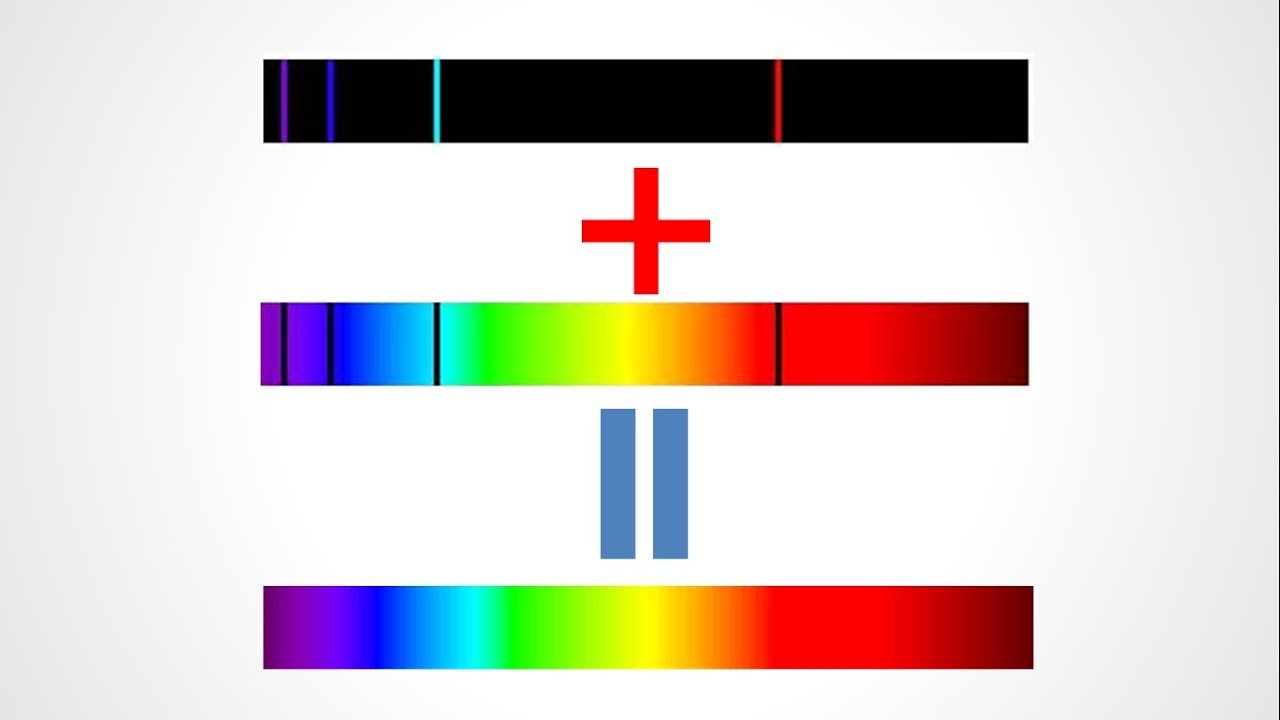
- يحتوي طيف الانبعاث الذري، ما يميز طيف الانبعاث الذري هو إمكانية تمييز العناصر بواسطته ، حيث لا يوجد عنصرين كيميائيين لهما نفس الطيف ، لذلك بقياس مطياف الشمس مثلا نستنتج أنه مكون من الهيليوم والهيدروجين.
- لذلك ، فإن الإجابة على سؤال تشرح سبب احتواء طيف الانبعاث الذري على ترددات معينة من الضوء وفقًا لنموذج بوهر الذري هو: نظرًا لأن طاقة ذرة عنصر معين معروفة ومحددة ، لذلك تنبعث ترددات محددة من الإشعاع من ولمزيد من التوضيح تابع معنا بقية المقال.
نموذج بوهر الذري
فسر لماذا يحتوي طيف الانبعاث ، فيما يتعلق بالعالم نيلز بور الذي اقترح هذا النموذج لتمثيل البنية الداخلية للذرة ، فإن نموذجه يعتمد على تفسير الخطوط الطيفية المنبعثة من ذرة الهيدروجين ، ونوضح في الخطوات التالية أهم الميزات لنموذج بوهر:
- لاحظ العلماء في أواخر القرن التاسع عشر أنه عند زيادة طاقة ذرات عنصر معين ، تشع ألوان ضوئية محددة ، وأن تلك الألوان لم تتغير لعنصر واحد ، وكانت تعتبر بصمة للعنصر ، ولكن لم يكن سبب ذلك معروفا.
- على سبيل المثال ، إذا مررنا تيارًا كهربائيًا على غاز الهيدروجين (H2) ، سينقسم الهيدروجين إلى ذرات (H) ، وسنرى بالعين المجردة أنه يصدر ضوءًا مميزًا بلون واحد ، بينما إذا مررنا الناتج الناتج الضوء من خلال منشور زجاجي ، سينقسم إلى 4 ألوان بطول موجة محدد ، وكلما كررنا التجربة ، نحصل على نفس النتيجة.
- فسر لماذا يحتوي طيف الانبعاث الطيف الذري ، إذن ، هو الألوان المحددة التي تنبعث نتيجة لإثارة العنصر النقي.
- فسر لماذا يحتوي طيف الانبعاث ، بحلول عام 1913 ، استخدم نيلز بور نموذج رذرفورد الذري ، والذي أظهر أن الذرة تتكون من إلكترونات سالبة تدور حول نواة موجبة الشحنة ؛ في تفسير التردد المنبعث من ذرة الهيدروجين.
- كان تفسير بوهر مفتاحًا لفهم حركة الإلكترونات حول نواة الهيدروجين. في نموذج بوهر ، يتضح ما يلي:
- تدور الإلكترونات حول نواة الذرة في مدارات مشابهة لمدارات الكواكب حول الشمس.
- كل إلكترون له مستوى معين من الطاقة.
- فسر لماذا يحتوي طيف الانبعاث كلما زادت طاقة الإلكترون ، كلما ابتعد مداره عن النواة.
- ومع ذلك ، ظهرت عقبة رئيسية أمام هذه النظرية ، وهي أنه بسبب الحركة المتسارعة للإلكترونات ، فإنها ستفقد المزيد من طاقتها وبالتالي تقترب جدًا من النواة حتى تنجذب إليها وتنهار الذرة وفقًا لـ هذا النموذج.
- لكن بور أوضح أن الاعتراض صحيح إذا كان بإمكان الإلكترون أن يمتلك أي مستوى من الطاقة ، لكن هذا ليس صحيحًا ، فالإلكترونات الموجودة حول نواة ذرة الهيدروجين تمتلك مستويات معينة من الطاقة ، وليس غيرها ، وأن هذه المستويات مرتبطة بـ أطياف الضوء المنبعثة نتيجة تسخين العنصر.
كيف يتم إنتاج طيف الانبعاث الذري
الطيف عبارة عن مجموعة من ألوان أشعة الضوء بعد تمريرها على مقياس طيف أو منشور ، وفي ما يلي نوضح كيفية إنتاج طيف الانبعاث الذري:
- فسر لماذا يحتوي طيف الانبعاث ، عندما تكتسب ذرة عنصر نقي في حالة غازية أو بخارية الطاقة عن طريق التسخين أو وضع العنصر تحت ضغط منخفض في أنبوب تفريغ كهربائي.
- هذا يعطي الإلكترونات الموجودة بداخلها طاقة حركية ، والتي تأخذها إلى مستوى أعلى في مدارها حول نواة الذرة.
- يحتوي طيف الانبعاث الذري، يعتبر هذا الوضع غير مستقر للذرة ، مما يجبرها على التخلص من تلك الطاقة ، وتعود الإلكترونات إلى مستوياتها الأصلية ، حيث يتم إخراج الطاقة المفقودة على شكل شعاع ضوئي ، وعند تحليل تلك الشعاع بواسطة مقياس الطيف. ، نحصل على طيف الانبعاث الذري الذي يحمل ترددًا محددًا لكل طيف على حدة.
وفي نهاية الموضوع نكون قد قدمن لكم ،فسر لماذا يحتوي طيف الانبعاث الذري على ترددات معينة للضوء وفقًا لنموذج نيلز بور. نأمل أن نكون قد استوفينا تدور الإلكترونات حول نواة الذرة في مدارات مشابهة لمدارات الكواكب حول الشمس.حتى عام 1913 ، استخدم نيلز بور نموذج رذرفورد الذري ، والذي أظهر أن الذرة تتكون من إلكترونات سالبة تحيط بنواة موجبة الشحنة ؛ شرح التردد المنبعث من ذرة الهيدروجين.